ANDA申報熱潮未退 半年內16家藥企斬獲41個申請號
據米內網數據,2019年上半年,有16家藥企在美國斬獲41個ANDA申請號,涉及39個品種(以藥品名稱+企業名計),同比上年同期有所增加。東陽光藥、海正藥業以6個ANDA并列首位,國內藥企的國際化道路上迎來新面孔——中美華東。39個品種中有17個已在國內上市或在國內申請上市/臨床,還有22個品種待轉報國內。
表1:2019年上半年中國藥企獲獲得FDA批準的ANDA
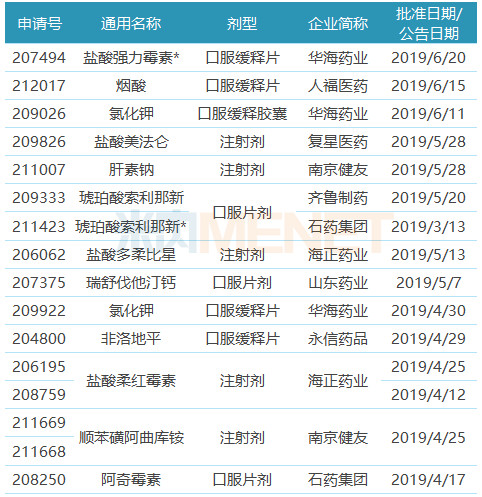
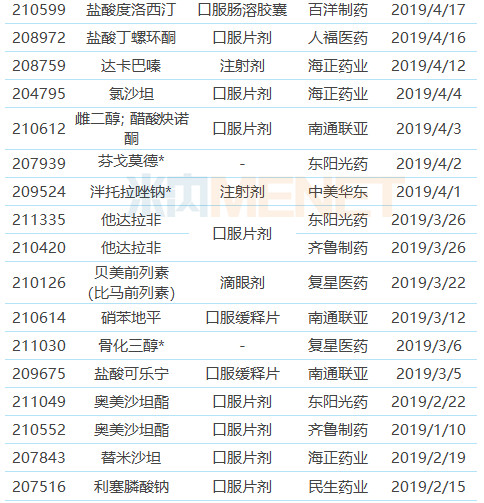
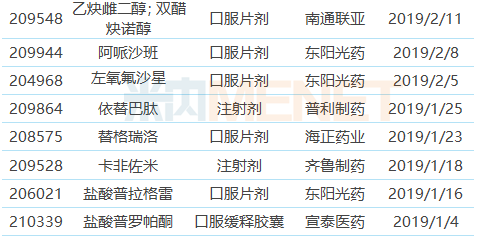
注:帶*為暫時獲批,下同
(來源:米內網FDA藥物目錄庫)
據米內網FDA藥物目錄庫,2019年上半年共有16家中國藥企獲得FDA批準的ANDA,共41個申請號,涉及39個品種(以藥品名稱+企業名計),同比上年同期有所增加。增加的主要原因在于:
一方面是美國政策鼓勵仿制藥上市,對于首個對原研發起專利挑戰并成功上市的ANDA仿制藥,將獲得180天的市場獨占期。
另一方面是國內仿制藥產業正在經歷大變革。近年來,政府部門通過開展仿制藥一致性評價達到“提質”的目的,又通過“4+7”國家帶量采購、77家藥企會計信息質量檢查等工作推動藥品“降價”。此外,印度藥企入華搶占市場謀劃已久,且近期進程有所加快,印度藥進入中國市場,或將成為刺激本土仿制藥產業升級的動力之一。
還有一方面是中美雙報的紅利刺激,國內藥品生產企業已在歐盟、美國和日本獲準上市的仿制藥,可以國外注冊申報的相關資料為基礎,按照化學藥品新注冊分類申報藥品上市,批準上市后視同通過一致性評價;在中國境內用同一生產線生產上市并在歐盟、美國和日本獲準上市的藥品,視同通過一致性評價。
圖1:2019年上半年國內藥企ANDA獲批情況(單位:個)
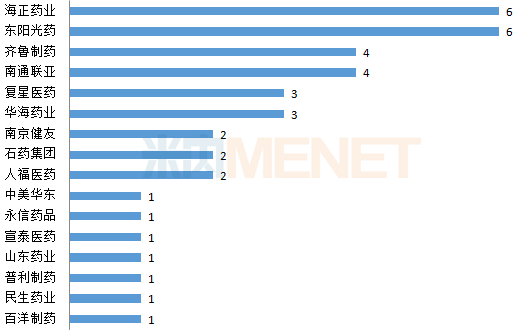
注:以品種數(藥品名+企業名)計
(來源:米內網FDA藥物目錄庫)
截至目前,已經有39個中國藥企(按母公司計)獲得了美國FDA批準的ANDA。2019年上半年,國內藥企的國際化道路上又迎來了一位新面孔——杭州中美華東。昔日霸主華海藥業或受此前沙坦原料藥事件影響,2019年上半年收獲3個ANDA,東陽光藥與海正藥業表現搶眼,均斬獲6個ANDA。
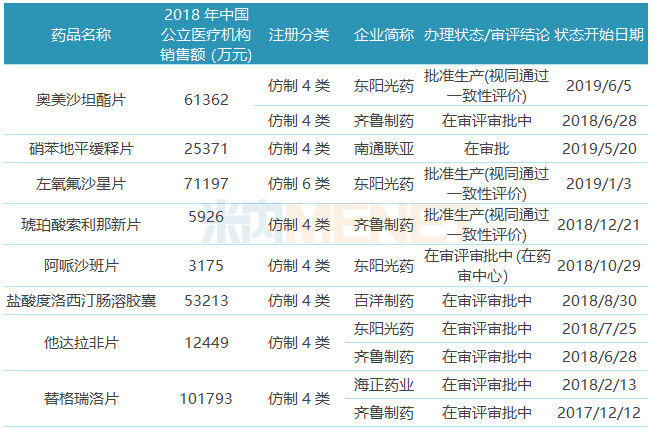
7個品種在國內上市,4個已過一致性評價
表2:已在國內上市或申報上市/臨床的品種
(來源:米內網數據庫)
39個ANDA品種中有17個已在國內上市或在國內提交上市/臨床申請,中美華東制藥的泮托拉唑鈉、海正藥業的柔紅霉素及多柔比星、石藥集團的阿奇霉素很早之前就已在國內獲批生產。
注射用泮托拉唑鈉是華東醫藥首個獲批的ANDA,目前國內市場擁有該產品批文的廠家有68家,中美華東制藥、揚子江藥業、奧賽康藥業、南京正大天晴已提交該產品一致性評價補充申請,處于“在審評審批中”狀態;石藥集團的阿奇霉素片按一致性評價補充申請提交申請并通過一致性評價,目前公司已有10個品種通過或視同通過一致性評價,除了阿奇霉素片外,鹽酸曲馬多片、硫酸氫氯吡格雷片、鹽酸二甲雙胍片也已在美國獲得ANDA。
東陽光藥的芬戈莫德、普拉格雷以新藥3.1類申報臨床,目前這2個品種在國內市場仍處于空白狀態。國內首個普拉格雷爭奪戰競爭激烈,包括東陽光藥在內,國內共有17家國內藥企、1家跨國藥企的鹽酸普拉格雷片獲批臨床。
9個品種按仿制藥4類/6類申報上市,東陽光藥的奧美沙坦酯片、齊魯制藥的琥珀酸索利那新片已獲批生產并視同通過一致性評價,其中齊魯制藥為琥珀酸索利那新片首家過評藥企;東陽光藥的左氧氟沙星片雖按仿制藥6類申報上市,但因為是海內外共線產品,因此獲批生產后也視同通過一致性評價,為該產品國內首家過評。南通聯亞的硝苯地平緩釋片、百洋制藥的鹽酸度洛西汀腸溶膠囊目前還在審評審批中,有望首家通過一致性評價。
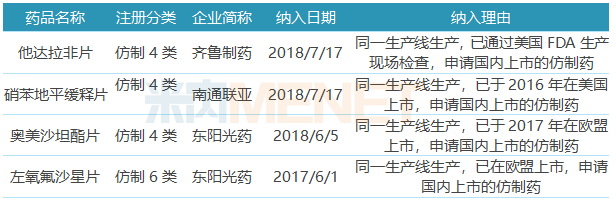
海內外雙報紅利明顯,22個品種有望報轉國內
表3:納入優先審評品種
(來源:米內數據庫、CDE官網)
已在國內上市或在國內提交上市/臨床申請的17個ANDA品種中有4個被納入優先審評,納入理由為“同一生產線生產,已在歐盟或美國上市,申請國內上市的仿制藥”,納入優先審評程序有助于加速產品上市進程。
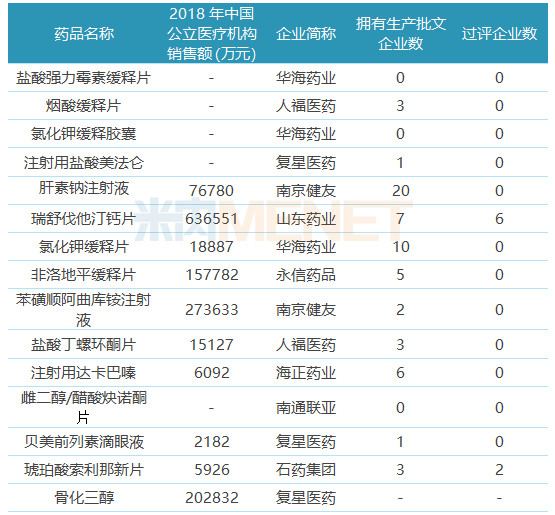
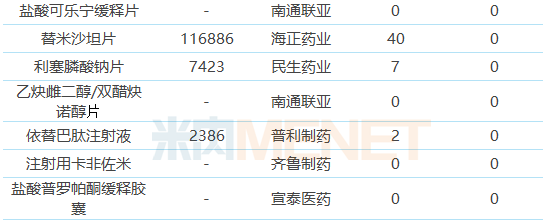
表4:未在國內申報上市/臨床的ANDA品種
(來源:米內網數據庫)
39個ANDA品種有22個暫時還未在國內申請上市或申請臨床,其中有7個品種在國內市場仍處于空白狀態,有2個品種目前僅原研廠家的產品在國內上市銷售,抓緊時間布局有利于率先搶占市場。
22個待轉國內的品種中僅瑞舒伐他汀鈣片、琥珀酸索利那新片有企業通過或視同通過一致性評價。“海外轉報國內”成為在國內通過一致性評價的捷徑,典型代表包括華海藥業、東陽光藥等,華海藥業目前有12個品種過評,其中有10個已獲得美國ANDA;東陽光藥有6個品種過評,其中有4個已獲得美國ANDA。
注射劑一致性評價進展緩慢,目前過評的品種中僅注射用阿奇霉素按一致性評價補充申請提交申請并通過一致性評價,其余注射劑均按新注冊分類申報上市,獲批生產后視同通過一致性評價。22個待轉國內的品種中有6個為注射劑,目前還未有企業過評。
來源:米內網數據庫、CDE官網
注:數據統計截至7月1日,如有疏漏,歡迎指正!









