多家全球頂級醫械公司產品召回!涉中國區銷售
藥監局發布公告,多家全球頂級械企主動召回問題產品
強生同月兩次召回問題產品
近日,國家藥監局發布公告,強生視力健商貿(上海)有限公司,對其生產的軟性角膜接觸鏡(商品名:美瞳水凝)(注冊證號:國食藥監械(進)字2014第3223882號)主動召回。召回級別為二級。涉及產品在中國的銷售數量為444盒,涉及生產批次為3批。
召回原因:旗下一定數量的特定批號安視優美瞳水凝(晶恬)隱形眼鏡鏡片存在裂口,破洞/氣泡,接到用戶投訴,因偶有配戴后會出現不適的癥狀。
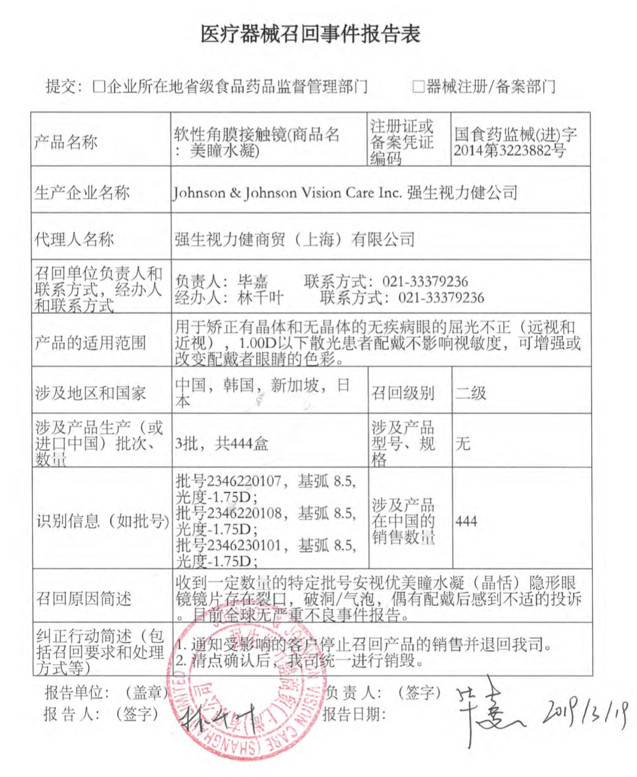
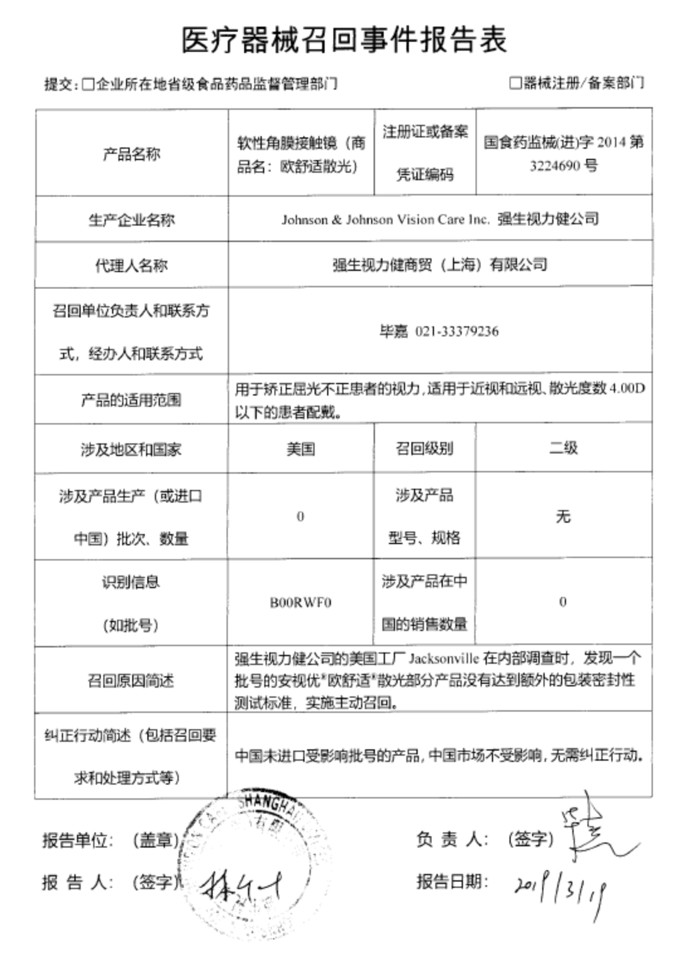
同月,在召回(商品名:美瞳水凝)的一周后,藥監局再發公告,強生視力健商貿(上海)有限公司報告,公司的美國工廠Jacksonville在內部調查時,發現一個批號的安視優“歐舒適”散光部分產品沒有達到額外的包裝密封性測試標準,注冊證編號:國食藥監械(進)字2014第3224690號)主動召回。召回級別為二級。目前涉及產品在中國區銷售的數量為零。
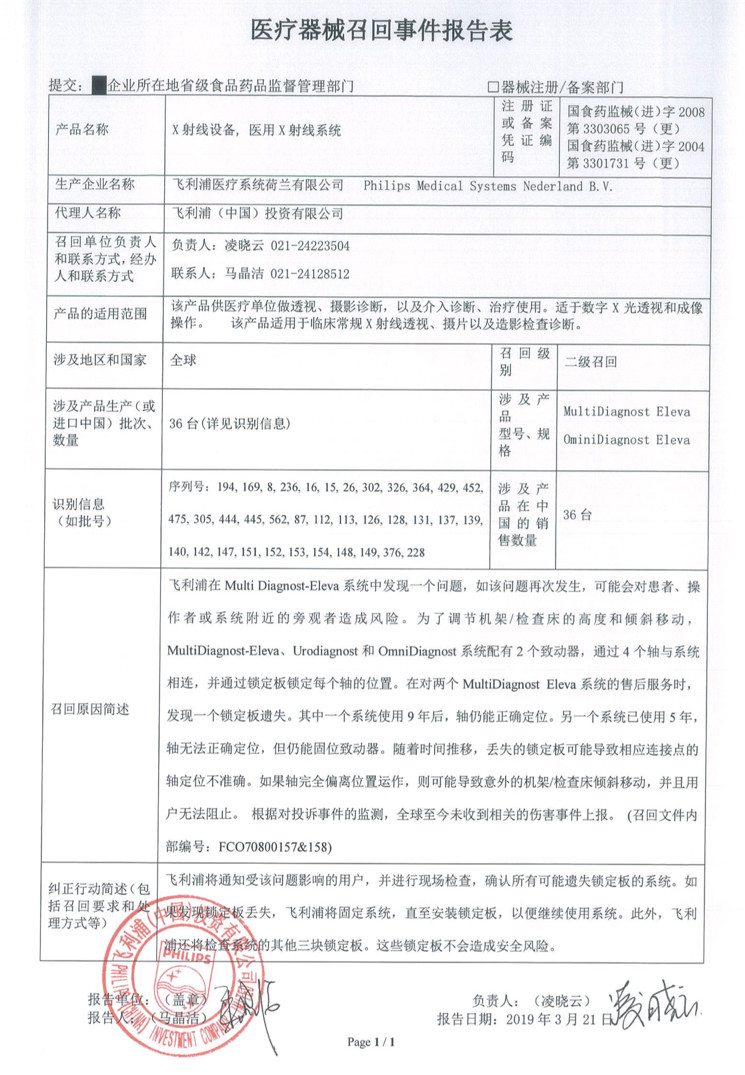
飛利浦召回存在安全隱患的X射線設備
飛利浦(中國)投資有限公司在報告指出,涉及產品為了調節機架/檢查床的高度和傾斜移動,系統配有2個致動器,通過4個軸與系統相連,并通過鎖定板鎖定每個軸的位置。在售后服務時,發現一個鎖定板遺失。其中一個系統使用9年后,軸仍能正確定位。
同時,另一個系統已使用5年,軸無法正確定位,但仍能固位致動器。隨著時間推移,丟失的鎖定板可能導致相應連接點的軸定位不準確。如果軸完全偏離位置運作,則可能導致意外的機架/檢查床傾斜移動,并且用戶無法阻止,這些問題的發生將會對患者、操作者或系統附近的旁觀者造成風險。
由此,飛利浦(中國)投資有限公司對其生產的X射線設備,醫用X射線系統(注冊證號:國食藥監械(進)字2008第3303065號(更),國食藥監械(進)字2004第3301731號(更))主動召回。召回級別為二級。涉及產品在中國的銷售數量為36臺(具體信息詳見表格)。
飛利浦公司在報告表中指出,企業將通知受該問題影響的用戶,并進行現場檢查,確認所有可能遺失鎖定版的系統。
今日,賽柏藍器械(ID: medchina)在查詢國家藥品監督管理局網站時發現,3月21日至3月27日公布的醫療器械召回通知里,所涉及的問題產品目前都不涉及中國區域銷售,產品未進口,企業上報相關事件到國家藥監局。

(截圖來源:國家藥品監督管理局)
召回級別按照缺陷程度劃分
賽柏藍器械統計了,從2019年初至今的醫療器械召回事件,從中發現召回級別多數為二級,少數為三級。
國家食藥監總局曾在2017年發布《醫療器械召回管理辦法》。
《辦法》指出,根據醫療器械缺陷的嚴重程度,醫療器械召回分成三級。醫療器械生產企業做出召回決定后,一級、二級、三級召回分別應在1日內、3日內、7日內,通知到有關醫療器械經營企業、使用單位或者告知使用者。《辦法》于2017年5月1日開始施行。
該《辦法》規定,醫療器械生產企業確定醫療器械產品存在缺陷的,應立即決定并實施召回,同時向社會發布產品召回信息。使用該醫療器械可能或者已經引起嚴重健康危害的,實施一級召回;可能或者已經引起暫時的、可逆的健康危害的,實施二級召回;引起危害的可能性較小但仍需要召回的,實施三級召回。實施一級召回的,召回公告應在國家食藥監總局網站和中央主要媒體上發布;二級、三級召回,召回公告應在省級食品藥品監管部門網站發布。









