恩華兒童新品擬優先審評 獨家申報沖擊國內首仿
7月13日,CDE官網公布最新擬優先審評品種,恩華藥業的鹽酸咪達唑侖糖漿(受理號CYHS2000375)擬優先審評的理由為“符合兒童生理特征的兒童用藥品新品質、劑型、規格”,目前國內市場尚無該產品獲批上市,也無其他藥企申報上市。
圖1:恩華藥業的鹽酸咪達唑侖糖漿具體情況

來源:CDE官網
米內網數據顯示,2019年在中國城市公立醫院、縣級公立醫院、城市社區中心及鄉鎮衛生院(簡稱中國公立醫療機構)終端咪達唑侖的銷售額為6.3億元,目前市場上獲批的產品包括了馬來酸咪達唑侖片、咪達唑侖注射液、咪達唑侖口頰粘膜溶液,注射劑市場份額占比最大,達96.43%。
圖2:中國公立醫療機構終端咪達唑侖的企業競爭格局
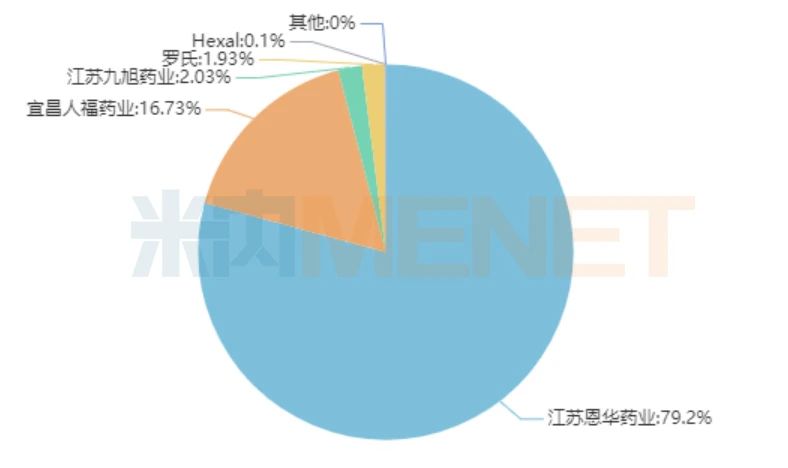
來源:中國公立醫療機構終端競爭格局
恩華藥業是該品種的領軍企業,2019年的市場份額達79.2%,擁有產品包括了咪達唑侖注射液、馬來酸咪達唑侖片。
圖3:鹽酸咪達唑侖糖漿的市場情況
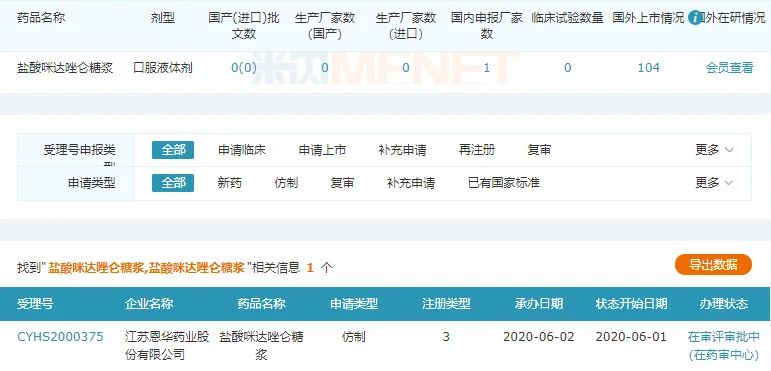
來源:米內網一鍵檢索
擬納入優先審評的鹽酸咪達唑侖糖漿目前市場上暫無企業獲批,恩華藥業是獨家申報,注冊分類為3類仿制,若順利獲批則視同過評,該產品上市后,有望提高該公司在咪達唑侖市場的領軍優勢。









