最新擬優先審評名單!全球“藥王”生物類似藥在列
2月25日、26日,CDE網站的擬優先審評品種公示欄目新增了7條信息。其中,信達生物的阿達木單抗注射液在列。
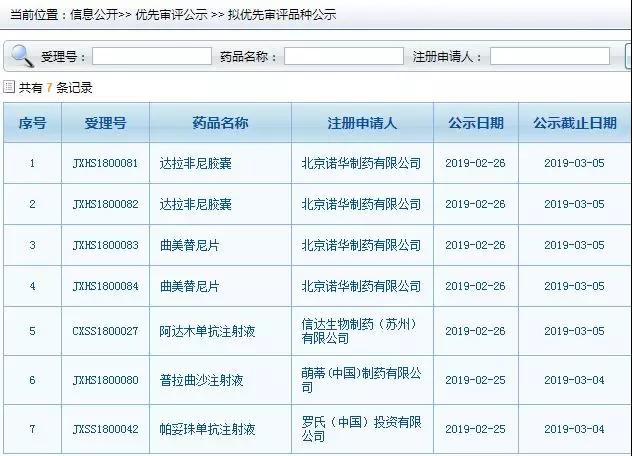
國內首個阿達木單抗生物類似藥的爭奪戰越來越激烈。目前,國內阿達木單抗類似藥在研企業已有20多家,其中,百奧泰、海正藥業、信達生物、復宏漢霖4家企業已經處于申請上市階段。有分析指出,從申報進度來看,百奧泰快于海正,海正快于信達,復宏漢霖剛在今年1月申報生產。
經查詢CDE網站,百奧泰的阿達木單抗注射液此前已被納入優先審評,如今,信達生物的阿達木單抗注射液也在進行擬優先審評公示,有望進一步提速。
阿達木單抗由艾伯維研發,商品名為“Humira”,2002年12月獲FDA批準,已在全球90多個國家獲批上市。2003-2017年該藥累計銷售額高達1159億美元,連續6年穩坐全球“藥王”寶座。2018年,Humira繼續稱霸,創下199.36億美元的銷售額。
不過,2018年Humira全球增速8.4%,此前每年兩位數的增幅不再延續。有分析師預測,2018可能就是阿達木單抗的銷售峰值。
Humira在歐洲的專利保護已經在2018年10月到期,幾款獲批的生物類似物全面開售。通過專利訴訟和解的方法,Humira在美國市場的專利保護雖然目前還能維持到2023年,但是艾伯維遭遇的市場壓力也越來越大。
2009年,艾伯維的阿達木單抗在我國獲批上市,商品名為修美樂。據國內樣本醫院數據統計,阿達木單抗2012年用藥金額為1809萬元,2016年為2208萬元,2017年為1795萬元,較同期下降11.5%。2018年前三季度,國內樣本醫院阿達木單抗用藥金額為1209萬元,預計全年超過1700萬元。
對比全球市場,阿達木單抗目前在中國的銷售情況并不理想,隨著更多適應癥在國內獲批,市場潛力依然巨大。









